Resumen
Los gorgojos de las leguminosas o escarabajos de las semillas, científicamente conocidos como brúquidos,
forman un grupo monofilético muy bien caracterizado desde el punto de vista morfológico y biológico, reuniendo
características únicas que le han merecido su consideración con rango taxonómico de familia. Sin embargo, su
posición taxonómica dentro del árbol filogenético de los Chrysomeloidea, que en los inicios de la Taxonomía
entomológica sufrió numerosos cambios hasta consolidarse como familia independiente (Bruchidae), desde mediados
del siglo XX ha estado sometida a una viva controversia, aún inacabada, entre taxónomos y filogenéticos. Para unos,
los brúquidos constituyen un grupo monofilético que se separó de los restantes Chrysomeloidea, como lo hicieran
anteriormente los Cerambycidae, por lo que debe mantenerse su status como familia independiente (Bruchidae). Para
otros, en cambio, estos insectos deben ser incluidos dentro de la familia Chrysomelidae con rango de subfamilia
(Bruchinae). En este artículo confrontamos los argumentos de ambas tendencias, a la vez que añadimos otros
elementos nuevos que nos llevarán a mantener, por ahora, la tesis del status de familia para estos coleópteros.
Abstract
Pulse weevils or seed beetles, scientifically known as bruchids, make up a monofiletic group which is well
characterised from a morphological and biological point of view, and exhibit unique features that have made them
deserve the taxonomical label of family. However, their taxonomical position in the phylogenetic Chrysomeloidea
tree, which at the beginning of the entomological Taxonomy went through many changes until it stabilised as an
independent family (Bruchidae), has been under a deep controversy, still unresolved, between taxonomists and
phylogenists ever since the middle of the twentieth century. On one side, bruchids are said to make up a monofiletic
group that separated from the other Chrysomeloidea, as the Cerambycidae did before, as hence their status as an
independent family should be preserved (Bruchidae). On the other side, by contrast, they claim that these insects are
parafiletics and must be included inside the Chrysomelidae family, at the sub-family level (Bruchinae). In this article
we will provide the arguments held by both sides, and at the same time we will add new elements which will lead us
to hold, for the time being, the hypothesis of the family status for these Coleoptera.
Introducción
La posición sistemática de los gorgojos de las leguminosas o, más precisamente, los
escarabajos de las semillas o brúquidos (Coleoptera: Bruchidae) ha sido controvertida desde los
comienzos de la historia de la Taxonomía y aún hoy día su posición, aunque mucho más
consensuada, todavía está sometida a discusión entre taxónomos y filogenéticos.
En efecto, como muchos otros grupos de insectos, los brúquidos fueron inicialmente
clasificados bajo denominaciones que actualmente corresponden a grupos muy diferentes, tales
como los Dermestidae, Curculionidae, Meloidae, etc. De hecho, en los primeros trabajos del
fundador de la Taxonomía, Linnaeus (1758), las primeras especies nombradas de estos
coleópteros aparecían bajo la denominación genérica de Dermestes (D. pisorum) o bien de
Curculio (C. chinensis), grupos que consideramos hoy día muy alejado de los brúquidos. Aunque
más adelante (1767) el mismo autor creó el género nominal Bruchus para otras especies de este grupo, la Comisión Internacional de Nomenclatura Zoológica lo puso en sinonimia de
Dermestes, una decisión que en la práctica no se ha respetado para evitar mayores problemas.
Por la misma época, Geoffroy (1762) incluyó estas especies dentro del género Mylabris
(Meloidae). Un poco más adelante, Scopoli (1773) creó para estos escarabajos el género Laria,
una denominación que conduciría a la creación de un grupo específico para los brúquidos: los
Lariidae, con el que se conocería hasta bien adentrado el siglo XX, a pesar de que por prioridad
le correspondía su nombre actualmente reconocido (Bruchidae). En efecto, obras como la
famosa “Histoire Naturelle des Coleoptéres de France” de G. Portevin (1934) todavía mantenía
la denominación de Lariidae para estos coleópteros. Pero al mismo tiempo coexistían
planteamientos que mantenían su inclusión dentro de los Curculionidae. De hecho, una de las
obras más importantes sobre estos insectos a finales del siglo XIX, el “Genera et species
Curculionidum” de Schönherr (1833-1845) con la colaboración de cuatro autores más
(Boheman, Fahreus, y Gyllenhal), mantenía a los brúquidos dentro de los Curculionidae.
El problema que se planteaba a finales del siglo XX consistía en determinar la familia
e incluso la superfamilia, a la que debían asignarse estos insectos. En este sentido, la polémica
estaba entonces entre situar estos insectos entre los Phytophaga o los Rhynchophora, esto es, si
son más cercanos a los Chrysomelidae o a los Curculionidae, pues ciertamente los brúquidos
aparentemente presentan caracteres intermedios que se reflejan de forma especial en su
hipermetamorfosis, donde aparecen estadios de larvas móviles (llamadas “crisomeloides”) y de
larvas ápodas (llamadas “curculionoides”), entendiéndose como un típico caso en el que se
cumpliría aquella famosa ley ontogenética según la cual la ontogenia (desarrollo embrionario)
recopila resumidamente la filogenia (evolución biológica).
En efecto, Latreille (1808) los consideraba un grupo de los Curculionidae y como hemos
señalado esta posición la mantuvieron muchos de los descriptores de especies de brúquidos
durante el siglo XIX (Schönherr et al.1833-1845). De hecho todavía vulgarmente se mantienen
denominaciones equívocas que aluden a su condición de “gorgojos” (weevils en inglés), un
término vernáculo que actualmente se reserva únicamente para los Curculiónidos y en todo caso
los Rhynchophora. Es posible que esta denominación vulgar proviniera de la coincidencia en los
almacenes con otros gorgojos auténticos, pero Latreille y otros autores de su tiempo utilizaban
como argumento su condición de coleópteros tetrámeros y una supuesta prolongación del rostro,
más al estilo de los Anthribidae que los típicos Curculionidae. De hecho, Latreille creó una
familia, los Bruchelidae, para incluir algunos Rhynchophora de rostro menos prolongado:
Rhinosimus, Bruchela, Anthribus y Bruchus. Esta relación se ha mantenido incluso en revisiones
de la primera mitad del siglo XX.
Sin embargo, fue Lacordaire (1866) quien puso en duda la relación, demasiado cercana,
de los brúquidos respecto de los Anthribidae, dentro del suborden Rhynchophora (hoy
superfamilia Curculionoidea), señalando una estrecha relación con los Chrysomelidae, dentro
del suborden Phytophaga (hoy superfamilia Chrysomeloidea). Esta posición parece que obtuvo
mayor consenso, por lo que finalmente estos insectos fueron colocados dentro del suborden
Phytophaga (hoy Chrysomeloidea), con los que comparte su condición de escarabajos sin el
rostro prolongado que definitivamente caracteriza a los Curculionoidea. No obstante, por este
tiempo en muchas obras los brúquidos conservaron la denominación específica de Lariidae en
muchas obras de la época. Fue Bridwell (1932) quien, en su revisión de la familia Bruchidae,
apartó los Bruchela (actualmente en los Urodoninae) de Latreille, si bien apartando también a los Rhaebus (entonces considerados como Chrysomelidae), que como veremos serían rescatados
de nuevo para los Bruchidae a mediados del pasado siglo XX.
De este modo, el sistema que se consolidaría desde mediados del siglo XX hasta nuestros
días presenta a los Bruchidae dentro del vasto suborden de los Polyphaga y la superfamilia
Chrysomeloidea, sobre la base de argumentos basados en investigaciones morfológicas de los
distintos estadios de desarrollo, descartándose cualquier relación cercana con los
Curculionoidea, como lo reflejan los siguientes caracteres (Crowson, 1954):
| 1.- |
Adulto: cabeza sin rostro, si aparece ligeramente frente a los ojos, las suturas gulares son marcadas y
separadas; cabeza nunca con ranura para la recepción del escapo antenal retraído; antenas nunca con los
últimos tres segmentos formando una maza definida. Larva: patas usualmente evidentes (a veces reducidas
y con 1-2 segmentos); mandíbulas nunca con mola; labium nunca con una barra hipofaríngea esclerotizada
transversa; antenas bien desarrolladas, usualmente con 3 segmentos evidentes.....................Chrysomeloidea
|
| 1'.- |
Adulto: cabeza con un rostro más o menos pronunciado, suturas gulares usualmente confluentes (si no, la
larva tiene mola mandibular); antenas usualmente geniculadas y terminadas en maza, con escapo retractable
en una muesca de la cabeza. Larva: patas normalmente ausentes; labium con una barra hipofaríngea
esclerotizada transversa en su superficie interna; antenas reducidas, usualmente con 1-2
segmentos........................................................................................................................................Curculionoidea
|
Aclarada la posición de los Bruchidae, como grupo encuadrable en los Chrysomeloidea,
la cuestión que se plantea desde entonces, principalmente a partir de argumentos filogenéticos,
es si los brúquidos deben mantenerse como familia separada de los Chrysomelidae (splitting),
o bien ser incluidos en éstos con el status de subfamilia (lumping) (Fig.1).
|
Figura 1.- Esquemas evolutivos conservador y renovado de los Chrysomeloidea (elaboración propia).
|
Planteamiento del problema
Si observamos el catálogo de citas de investigadores que se han pronunciado sobre este
problema (Tabla 1), advertimos que el cuestionamiento sobre la separación de los Bruchidae de
los Chrysomelidae ya fue planteado por Böving y Craighead (1931), sobre la base de su estudio
de las formas larvales de los coleópteros, indicando que los Bruchidae deberían formar parte de
los Chrysomelidae con rango de subfamilia. Sin embargo esta cita no tuvo suficiente eco entre
los coleopterólogos y fue Crowson (1953) el que retomaría el problema si bien inicialmente, sin pronunciarse de forma definitiva. Desde este fecha,
que podríamos considerar como seminal para los
trabajos de taxonomía filogenética en el orden
Coleoptera, se sucedieron diversos trabajos que
venían a apoyar la tesis de Crowson de incluir a los
Bruchidae, con rango de subfamilia, dentro de los
Chrysomelidae, siendo Monros (1960) uno de los
primeros autores en proponer un nuevo modelo
filogenético para los Chrysomeloidea (Fig. 2), que
por entonces contaba con tres familias:
Cerambycidae, Bruchidae y Chrysomelidae. En su
esquema evolutivo, Monros consideraba a los
brúquidos como un grupo derivado de los Sagrinae,
por lo que propuso llevarlo al status de subfamilia
de los Chrysomelidae o bien como tribu de los
Sagrinae, al considerar éstos como más
pleisomórficos que los brúquidos. De este modo, en
dicho esquema evolutivo, y considerando en tronco
basal a los Cerambycidae, los brúquidos (línea
roja) forman la 4ª subfamilia de la sección I
(Chrysomelidae) y la legión B (Chrysomelae),
formando un grupo que llamó Crioceriformes que
comprende, además de los Bruchinae (4), los
Sagrinae (1), Donaciinae (2) y Criocerinae (3). Sin
embargo, el autor apenas justifica la inclusión de
los brúquidos en los Crioceriformes, ni los incluye en la definición del tal grupo y tampoco en
la clave de subfamilias del mismo. Anteriores a éstos existen familias primitivas (en la figura
el plano inferior EE’: los antiguos Eupoda) del que derivan las familias actuales (plano AA’).
|
|
| |
Figura 2.- Esquema evolutivo de los Chrysomeloidea a partir de Monros (1960) (retocado del original). |
 |
|
Pero no fue hasta el estudio de Mann y Crowson (1981), que los Bruchinae empezaron
a ser tratados explícitamente como una subfamilia dentro de los Chrysomelidae. Las reacciones
a este aparente consenso entre taxónomos y filogenéticos no llegarían hasta que Borowiec
(1987), un destacado especialista en Bruchidae, defendiera la necesidad de mantener a los
Bruchidae con el rango de familia.
Con posterioridad a los estudios de
Crowson, diversos investigadores,
desde estudios filogenéticos, siguieron
defendiendo el status de subfamilia, lo
que incluye a Schmitt (1989), Chen
(1985), Lawrence (1991), Lawrence y
Britton (1994) y Reid (1995). El
trabajo de Schmitt, basado en el
estudio de las subfamilias más
cercanas a los Bruchidae, estableció
dos clados: el de los “Crioceriformes”
(Sagrinae, Criocerinae y Donaciinae)
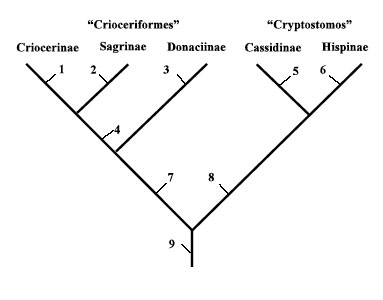
y el de los “Cryptostomos” (Hispinae y Cassidinae). En su cladograma basado en la setas
tarsales bífidas (Fig.3) el autor encontró 9
posibilidades (en la figura 1-9) para aproximar los
Bruchidae en estos clados, identificando la nº 9
como la más favorable. Esto le llevó a apoyar la
propuesta de Man y Crowson de colocar a los
brúquidos |
Figura 3.- Cladograma de los Crioceriformes y los Cryptostomos
según Schmitt (1989) (retocado del original).
|
|
como subfamilia dentro de los Chrysomelidae, si bien admitía el mantener el
status de familia por razones de estabilidad y no
ambigüedad de la comunicación científica, como
se reiterara más adelante (Schmitt, 1998). |
Seguidamente debemos destacar los estudios de
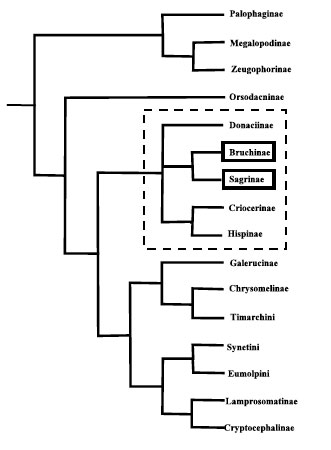
Reid (1995; 2000), quien al principio (Reid, 1995)
realizó un análisis de las relaciones cladísticas de
29 taxa con rango de subfamilia, en torno a 71
caracteres morfológicos del adulto y de la larva,
utilizando como grupos externos a Curculiónidos y
Cerambícidos. El estudio condujo a dividir los
Chrysomeloidea en 4 grupos, en uno de los cuales
(Chrysomelidae) incluyó a los brúquidos en un
clado con los Sagrinae (Fig.4). Este estudio será
completado en un estudio posterior (Reid, 1995),
pero entonces ya contó con algunas reacciones.
En efecto, ante esta creciente aceptación tácita del status de subfamilia, Kingsolver
(1995), otro especialista en estos insectos, retomaría el asunto y provocaría una viva polémica
en la revista Chrysomela Newsletter que resumiremos en este artículo. A pesar de ello, los
últimos estudios (ej.Reid, 2000 y Farrell y Sequeira.,2001) y este mismo artículo demuestran que
el debate científico aún no ha acabado.
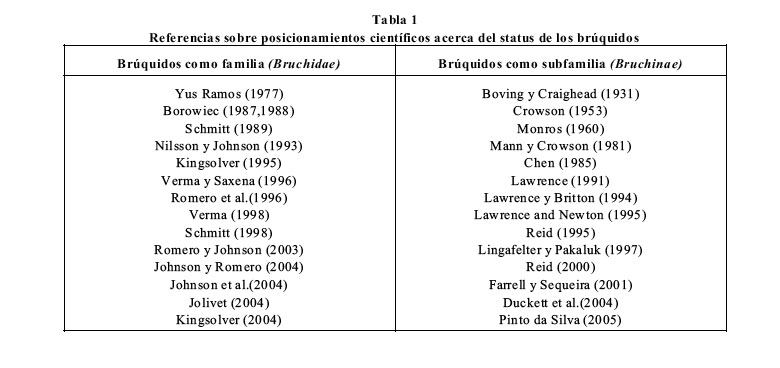
El examen de las citas que muestra la Tabla 1 (no todas detalladas en la bibliografía) nos
revela que, en términos generales, los defensores del mantenimiento del status de familia son
principalmente taxónomos y sistemáticos especializados en los Bruchidae (y algunos también
de Chrysomelidae), mientras que los detractores son principalmente filogenéticos y taxónomos
de niveles supragenéricos (y especialistas en Chrysomelidae) .
|
 |
| |
Figura 4.- Cladograma de consenso estricto de siete árboles
en los Chrysomelidae de Reid (2000) (retocado del original).
|
 |
Sin afán de obtener conclusiones precipitadas y simplistas, al menos da que pensar esta
dicotomía, que posiblemente pueda llevar al lector a considerar la influencia de aspectos
extracientíficos en esta polémica. Sin embargo, como mostraremos, en realidad esta polémica
se ha sustentado en argumentos sólidos y serios de una y otra parte, por lo que consideramos
poco acertada, por inexacta e injusta, la afirmación de Reid (2000) de que el mantenimiento
actual del status de familia para los brúquidos sólo se debe a “razones políticas y no a razones
científicas”. Esperamos demostrar con este artículo que, al contrario, hay razones científicas, a
nuestro juicio valiosas, como para mantener el status de familia para estos insectos.
Para plantear la base de este debate podemos resumir la polémica reflejada sobre esta
cuestión en sucesivos números de la revista Chrysomela Newsletter. El inicio de la misma corrió
a cargo de Kingsolver (1995), especialista en Bruchidae del Nuevo Mundo, que defendió,
creemos que acertadamente, los puntos fuertes que mantienen la tesis de la monofilia de los
Bruchidae:
1.-Adulto. Superficie del cuerpo setosa, a veces oscuramente; cabeza hipognata u
opitosgnata; ocelos ausentes; ojos aplanados para emarginarse profundamente; antenas de 11
artejos con inserción adyacente al ojo; ápice mandibular agudo, margen medio entero, no
dentado; suturas gulares cortas, terminando en fosetas tentoriales; sutura fronto-clipeal bien
marcada; estrías elitrales siempre presentes, usualmente en número de 10; metatibias usualmente
carenadas longitudinalmente; uñas tarsales apendiculadas; pigidio expuesta más allá de los
ápices elitrales; genitalia del macho con base del lóbulo mediano y punta ventral del tegmen
modificados en una bomba para eyectar el saco interno durante la cópula; lóbulos (parámeros)
laterales siempre presentes.
2.-Larva. Escleroma labial presente en los estadios larvales 2-4; patas reducidas o
ausentes (excepto algunas formas de primer estadio); mandíbula en forma de gubia; escleritos
pronotales presentes en la larva de primer estadio.
3.-Hábitos. La larva se alimenta exclusivamente en las semillas (espermofagia); la
ovoposición siempre sobre la semilla o sobre la envoltura que contiene las semillas; la pupación
se produce en la cámara alimentaria larval en la semilla; la larva madura labra un túnel hasta la
superficie de la semilla, o a veces a la envoltura o superficie de la vaina antes de volver a la
cavidad para pupar; alrededor del 80% de las especies están asociadas con plantas huéspedes
leguminosas.
El autor concluye con la hipótesis de que los brúquidos nacieron de un antecesor común
con la subfamilia crisomélida Sagrinae, apuntando a una divergencia relativamente reciente de
los brúquidos seguidos por el desarrollo de la espermofagia en un grado excelente.
Por lo tanto, sea que los Bruchidae debieran mantenerse como familia, en cuyo caso casi toda subfamilia de los Chrysomelidae debería ser una familia (como han sugerido Boving y
Craighead, 1931) o, que la mayoría de las subfamilias no son muy diferentes unas de otras y sus
relaciones no son siempre claras, la mayoría de las subfamilias, incluidas los Bruchinae, pueden
ser consideradas como otra familia, los Chrysomeloidea.
Sin embargo, la asunción de esta “hermandad” entre Sagrinos y Brúquidos descalifica,
en opinión de Reid (1996) la separación de los Bruchidae de los Chyrsomelidae. Reid recuerda
que una clasificación debería reflejar la relación con grupos hermanos con igual rango, en este
caso los Sagrinae y los Bruchinae. Si se separan en familias distintas se interpreta como una norelación,
pero si comparten el mismo rango quiere decir que comparten ancestros comunes,
luego la clasificación debe acomodarse a esta relación, no cuestionada, entre Bruchinae y
Sagrinae. Para este autor, la alternativa a esta aproximación cladística es la confusión.
Ante esta reacción, Verma y Saxena (1996) trataron de apoyar a Kingsolver, añadiendo
a sus argumentos otro más de tipo ecológico, ya que estos argumentos son admitidos como un
criterio importante para decidir si un taxón superior ha de ser tratado como familia. En efecto,
Mayr (1969) decía al respecto que “la mayoría de los taxa superiores, particularmente a nivel
de género y de familia, ocupan un nicho o
zona adaptativa bien definida. Ellos deben
su origen a la invasión de esta zona por una
especie fundadora y a la consiguiente
radiación activa y adaptativa que
usualmente sigue a un cambio adaptativo
exitoso”. También ve la posibilidad de
invasiones secundarias de la zona
adaptativa, conduciendo al desarrollo de
adaptaciones estructurales muy similares, y
dando como resultado un origen
estrechamente polifilético de una familia.
La familia usualmente se distingue por
ciertos caracteres adaptativos que se ajustan
a un nicho particular o zona adaptativa. En
este contexto, recuerda Verma, es
significativo señalar que las tres familias convencionalmente reconocidas de Phytophaga son
ecológicamente distintas en su vida larval: los Cerambycidae son xilófagos (madera viva o
muerta. En cambio, los Chrysomelidae son foliófagos (externamente o internamente como
minadoras). Finalmente, los Bruchidae son exclusiva-
|
|
|
mente espermófagos, por lo que desde el
punto de vista ecológico este grupo forma una familia bien definida. De este modo, el árbol
filogenético que propone Verma y Saxena (Fig.4) representa unos cambios adaptativos |
|
Figura 5.- Esquema evolutivo de los Chrysomeloidea según Verma y Saxena (1996)
(retocado del original). |
cruciales
(en la figura en línea de puntos) que conducen a la colonización de nichos ecológicos
diferenciados desde donde se inicia una radiación adaptativa. En un artículo posterior,
Lingafelter y Pakaluk (1997) discuten la validez de este criterio ecológico propuesto por Verma
y Saxena, considerando que existe infinidad de casos de convergencia en nichos ecológicos de
grupos muy apartados. A lo que Verma (1998) contestó posteriormente que su propuesta no era
considerar este factor como único ni determinante, sino como uno más que sólo cobra relevancia
cuando se considera dentro de un conjunto de factores como los señalados por Kingsolver
(1995).
Lingafelter y Pakaluk (1997) recordaron aquí que, aunque la propuesta de incluir los
brúquidos como subfamilia de los Chrysomelidae no es nueva (ej.Boving y Craighead, 1931 y
Crowson ,1953), añadiendo además que los autores que aparentemente se oponen a ello, como
Kingsolver y Verma, implícitamente lo reconocen también al admitir dos aspectos claves en esta
discusión: a) que los brúquidos provienen de un antecesor común con los Sagrinae; y b) que los
brúquidos son derivados de este antecesor relativamente recientes. Desde estas afirmaciones, los
autores recuerdan que Mayr y Ashlock (1951) postulaban que ningún taxón debería caer fuera
del paso de sus grupos hermanos. Según esta argumentación, los brúquidos deben ser alineados
como una subfamilia, comparable con su taxon hermano (los Sagrinae). Para estos autores,
aceptar a los brúquidos como familia significa que las características compartidas y derivadas
que tiene con los Sagrinae (resumidas en Reid, 1995) son consideradas como irrelevantes. La
consideración de los brúquidos como no puede ser lógicamente ignorada por tan sólo los únicos
caracteres (autapormofismo) y primitivos (plesiomorfismo), o singularidad ecológica de los
brúquidos. Lingafelter y Pakaluk terminan recordando que la clasificación debe seguir la
filogenia aceptada o de lo contrario no es predictiva, de modo que si se propone una
clasificación diferente (i.e.separar a los brúquidos como familia aparte), solo puede ser porque
la relación (con los Sagrinae) no es aceptada, pero entonces hay que presentar las razones para
una hueva hipótesis.
Finalmente, Verma y Saxena (1996) introducen otro elemento en la discusión y es la
necesidad de buscar consensos en ambas líneas de investigación, de modo que reconociendo la
utilidad de los descubrimientos filogenéticos, no se debería perder de vista los principios bien
establecidos de la taxonomía cuando se sugieren agrupamientos y reagrupamientos de
organismos, pues de lo contrario la clasificación sería tan voluble que no sería útil para la
comunidad científica.
Frente a estos argumentos, Duckett (1997) criticó la mistificación de la “estabilidad
taxonómica” y resaltó la importancia de la aproximación filogenética, señalando que la
filogenia destaca por su alto valor predictivo y que la clasificación basada en la filogenia es
democrática dado que no favorece a ninguna disciplina en particular, lo que considera como un
fuerte argumento en contra del mantenimiento de una clasificación errónea en pro de la
“estabilidad taxonómica”. La estabilidad taxonómica, señala la autora, solamente es válida en
la medida en que una clasificación dada comunique información útil a la comunidad. Dado que
la comunidad científica está siendo cada vez más diversa en su interés sobre la biología de los
organismos, sólo las clasificaciones que predigan la mayoría de los aspectos de las mayor parte
de los organismos será útil. Más aún, dado que la clasificación es el producto del método
científico (aquél que propone hipótesis y comprueba estas hipótesis con congruencia con datos
reales), la clasificación basada en el método científico puede necesitar ser alterada conforme
nuevos datos son obtenidos y viejas hipótesis son falsadas. Por lo tanto, la “estabilidad
taxonómica” no es un argumento científicamente defendible.
Más adelante (Verma, 1998) y como contestación a la críticas anteriores, recordó a estos
autores que las mismas fuentes señaladas por ellos (Mayr y Ashlock, 1991) indican que suele
haber arbitrariedad en la confección de taxa de orden superior, y que el papel de la arbitrariedad
es más pronunciado en el caso de familia y subfamilia, por lo que es completamente natural y
frecuente que haya diferencia de opinión entre especialistas sobre la categoría de un taxón
superior, especialmente si es a nivel de familia, como es el caso. Por esta razón, Verma concluye que a la vista de la arbitrariedad implicada en la decisión de si los brúquidos son tratados como
familia o subfamilia, sería mejor mantener el status convencional de familia para este grupo,
dado que la estabilidad es una consideración en la clasificación, aunque pueda no ser una
consideración principal. Paradójicamente, una de las finalidades de la filogenia es asegurar la
estabilidad del sistema y evitar la arbitrariedad en la taxonomía (Queiroz y Gautier, 1992).
Termina este foro de discusión Schmitt (1998) en una línea pragmática convergente con
Verma (1998) en algunos puntos. Frente a la crítica de Duckett por la defensa de la “estabilidad
taxonómica” aducida por Verma, el autor explica que esta propuesta es razonable si se considera
la ciencia como un proceso social, en cuyo caso el compartir y comunicar información científica
constituye una parte integral de ella. Para el intercambio de información, la estabilidad de
términos y nombres es un pre-requisito necesario. Por lo tanto, señala Schmitt, el cambio de
nombres establecidos no debería ser solamente un asunto de ajuste de una clasificación a las
hipótesis filogenéticas más recientes, sino que también debería tener en cuenta los
requerimientos de la comunicación inequívoca. Violar la lógica formal situando a grupos
hermanos diferentemente o incluir una “familia” dentro de otra no es sino una desventaja de
mantener clasificaciones “tradicionales” a pesar de las hipótesis filogenéticas más recientes. Esta
desventaja puede ser bien compensada por la ventaja de un intercambio más fácil de información
y recuperación de la información. La filogenia, como parte de la ciencia, cosecha hipótesis que
están a la espera de su falsificación y rechazo. Además, señala el autor, tiene sentido tener
presente que “los cambios en el orden en la clasificación no resuelven ningún problema
filogenético”. Consecuentemente, podría ser apropiado presentar hipótesis filogenéticas sin
cambiar ordenamientos y nombres. Por lo tanto, sería sensato no revisar demasiado pronto una
clasificación de acuerdo con una hipótesis filogenética, siendo recomendable que haya algún
tiempo de discusión. Por esta razón, señala Schmitt, en el momento presente, parece mejor
sustanciado contemplar los Sagrinae y los Bruchidae como grupos hermanos, pero los caracteres
de apoyo no son todavía tan convincentes como quieren hacernos creer los defensores del rango
de subfamilia para los brúquidos.
Las afinidades de los Bruchidae y los Chrysomelidae
Pensamos que una buena forma de empezar a comentar este debate es destacar los
aspectos en los que sí hay acuerdo. Estos se centran principalmente en las afinidades
taxonómicas y biológicas entre los Bruchidae y los Chrysomelidae. Crowson (1954) decía al
respecto que la filogenia de los Chrysomeloidea presenta una atractiva imagen en la que la
evolución de los hábitos alimenticios de las larvas van siguiendo una línea ascendente desde sus
raíces: las formas más primitivas se encontrarían viviendo en el suelo, alimentándose de hongos
y restos vegetales (detritívoros). En un artículo posterior Crowson (1960) situaba el inicio de este
proceso evolutivo en el Jurásico, de donde también arrancarían los Curculionoidea. El tipo
primitivo, afirmaba Crowson, probablemente tuviera caracteres primitivos como el tipo de
venación alar de los adultos, y la presencia de lígula en la larva de los Cerambycidae. La larva
crisomeloide ancestral vivía internamente en el tallo, probablemente madera muerta y el adulto
era de vida libre frecuentando los precursores de las Angiospermas. A partir de estas formas
primitivas, se derivaría primero una rama que se especializó en madera del tronco (xilófagos:
Cerambycidae) y proseguir por las partes aéreas, con una rama alimentándose de hojas
(foliófagos: Chrysomelidae) y otra de carpelos (espermófagos: Bruchidae). Es decir, lo que hoy
podríamos considerar como una colonización de distintos nichos ecológicos dentro de la condición común de escarabajos fitófagos. Crowson (1960) consideraba que algunas subfamilias
de los Chrysomelidae, como los Megalopodinae y los Orsodacninae eran las más primitivas, por
la presencia de ciertos caracteres considerados como primitivos, como es la lima estriduladora
mesonotal (presente también en algunos brúquidos) y el tegmen bilobulado del adulto, así como
el tipo de larva, muy parecidos y cercanos a los Cerambycidae.
Pero esta imagen supone considerar que la vida endofita es primitiva (plesiomórfica) y
la vida exofita es derivada (apomórfica), una generalización que colisiona con otras visiones que
contemplan la vida exofita como más primitiva, hecho que llevaría a algunos autores, como
Ganglbauer (1892-199), a sugerir que los Chrysomelidae son antecesores de los Curculionidae.
Pero ya hemos visto que los Curculionidae tienen caracteres que lo alejan de los Chrysomelidae
en un tronco aparte de los Polyphaga. Sin embargo, es cierto que en esta imagen del árbol de
Crowson, los Bruchidae aparecen con una vida esencialmente endofita, representando
ontogénicamente una evolución inversa: el paso de una vida exofita (larva móvil o crisomeloide)
a una vida endofita (larva ápoda o curculionoide), una vida endofita en la larva y exofita en el
adulto (que se alimenta de polen y rara vez mordisquea otros tejidos). En este caso tendríamos
que considerar, si mantenemos esa imagen del árbol de Crowson, el “regreso” evolutivo
(adaptación secundaria) a una vida endofita en el caso de los Bruchidae, aunque en este caso
especializada en las semillas. Pero en cualquier caso estamos admitiendo la existencia de un
parentesco, de antepasados comunes entre Bruchidae y los Chrysomelidae, con una
individualización anterior de los Cerambycidae.
En un estudio posterior, Farrell y Sequeira (2001) trabajaron con esta misma hipótesis
en su análisis cladogenético. Analizando las tasas de uso de huéspedes en los Chrysomeloidea,
concluyeron que los cambios en el uso de taxones de planta huésped han evolucionado más
rápidamente que los cambios en el uso de diferentes tejidos de plantas. Para estos autores, la
radiación adaptativa de los Chrysomeloidea se aproxima al momento de la aparición de sus
respectivas plantas huéspedes, de modo que muchas de las filiaciones con los principales grupos
de taxa de plantas huéspedes son fuertemente conservadoras en todas las subfamilias. La
asociación de Palophaginae fósiles con especies de Araucaria en capas del Jurásico indica para
estos autores que muy posiblemente las primeras plantas usadas por los antecesores de los
Phytophaga actuales fueran ciertas gimnospermas, hasta que se produjo la radiación de las
Angiospermas. De este modo, afinando un poco más la imagen de Crowson, los antecesores de
los Phytophaga se remontarían al Jurásico (hace 150 m.a.), que tenían una vida endofitica,
alimentándose de los estróbilos de Gimnospermas. Esta época fue seguida de una
diversificación de hábitos de alimentación de insectos y huéspedes de Angiospermas,
apareciendo un cambio a hábitos foliófagos en el Cretácico, con subfamilias como los
Criocerinae-Hispinae que irradiarían en el Terciario en una diversificación de formas de
alimentación: minadoras de hojas, depredadoras de semillas (espermófagas) y de raíces. Para los
citados autores, los fósiles y proximidad filogenética de los linajes de Donaciinae, Criocerinae
e Hispinae en una posición intermedia en la filogenia, sugieren un origen común de las especies
comedoras de hojas en el Cretácico, comparable con el origen de los gorgojos. Ambos grupos
de coleópteros se diversificaron durante el Cretácico Medio. Se piensa que la base de esta
radiación es la competición por los recursos, lo que explicaría que los crisomeloides de hábitos
exofiticos (foliófagos) sufrieran mayor diversificación que los de hábito endofíto (espermófagos)
que muestran un espectro de huéspedes mucho más restringido.
De este modo, situados los Bruchidae junto a los Chrysomelidae en el tronco de los
Chrysomeloidea más evolucionados, el problema que se plantea está en las relaciones
filogenéticas entre ambos grupos, y con ello entramos en el corazón del dilema actualmente
planteado: ¿los Bruchidae se individualizaron antes o después de que se consolidaran los
Chrysomelidae? En el primer caso estaríamos ante un grupo con rango de familia aparte, pero
en el segundo caso habría que tratarlo como una subfamilia de los Chrysomelidae.
Para Kingsolver (1995), los grupos aparentemente más cercanos a los Sagrinae están en
la subfamilia de los brúquidos Pachymerinae, especialmente el género Caryoborus Schöenherr
1833 y Caryobruchus Bridwell, 1929. Pero a diferencia de Crowson (1946), Kingsolver
consideraba que los sagrinos más parecidos a los pachymerinos son los Carpophagus
MacLeay,1827 por características tales como: genitalia del macho con un lóbulo mediano
simple, curvado y tubular, bases de los lóbulos laterales fusionados a modo de tirante con tan
sólo los ápices extendidos; ausencia de un buche en el sistema digestivo; metafémures hinchados
con dentículos ventrales; metaespisternón con un surco angular (también encontrado en algunos
Cerambycidae primitivos); patrones de venación alar semejantes, incluida la presencia de una
celda en forma de cuña en algunas especies; larva como depredadores internos de las plantas (en
los sagrinos en los tallos o copas, en los paquimerinos en las semillas). Pero existen también
importantes diferencias y el autor señala, entre otras, las siguientes: los élitros en todos los
Bruchidae siempre están estriados mientras que los de Carpophagus MacL.y la mayoría de los
restantes sagrinos les faltan estrías claras; frente con la costilla mediana en los paquimerinos,
los sagrinos tienen un surco frontal en forma de X; en cuanto a las larvas, la de los paquimerinos
tienen mandíbulas en forma de gubia, siendo dentadas en los sagrinos.
Esta “hermandad” entre sagrinos y brúquidos tiene implicaciones taxonómicas diferentes
desde los estudios filogenéticos. De este modo, Farrell y Sequeira (2001) parten de considerar
a los brúquidos como subfamilia de los Chrysomelidae, tal como anteriormente postulara Reid
(1995). Aludiendo a este grupo, señalan que la relación de grupos hermanos entre espermófagos
Bruchinae y comedores de tallo e inductores de agallas Sagrinae sugiere una progresión desde
la alimentación ancestral interna en el tallo a la inducción de agallas y la alimentación de
semillas a finales del Cretácico. De este modo, el grupo de alimentadores de semillas está entre
los grupos de alimentación más jóvenes en insectos herbívoros. El grupo de alimentadores de
semillas, entre los cuales destacan los Bruchidae, ha tenido muy pocas incorporaciones entre los
herbívoros más recientes. Similarmente los linajes de Cerambycidae del Jurásico-Cretácico
sufrieron una abrumadora diversificación, pudiendo parecer sorprendente que ningún
Cerambycidae haya evolucionado a alimentación exofita, pues posiblemente esto tenga que ver
con la colonización de este hábitat por los Chrysomelidae. Es más, cuando los Cerambycidae
se han apartado de su nicho ecológico tradicional, se han mantenido en la vida endofita, como
sucede con Leptostylus gibbulosus Bates,1874, que evolucionó secundariamente a un hábito
espermatofágico en semillas de Sapindus saponaria L. (Romero-Nápoles et al., en prensa).
La cuestión que planteamos en este punto es que, admitido que los Bruchidae se
apartaron precozmente de los actuales Chrysomelidae, de vida esencialmente exofita,
precisamente al retornar sus antecesores a la vida endofita, este hecho, junto a otras evidencias,
justificaría su separación taxonómica en calidad de familia hermana, pero separada de los
Chrysomelidae. Pensamos, coherentemente con la reflexión de los citados autores, que
posiblemente la competición entre los ancestrales Chrysomeloidea de vida exofita provocara la utilización de algunos recursos primigenios de vida endofita para reconducirlas hacia un nicho
ecológico (las semillas) prácticamente vacío en aquellos primeros tiempos de radiación de las
Angiospermas. Éste sería un caso muy gráfico y evidente de separación de linajes supragenéricos
que aparecen por especiación simpátrida que, dada la precocidad con que aparece en la historia
evolutiva de los Chrysomelidae, no parece razonable mantener ambos grupos en una misma
familia.
La cercanía de las subfamilias más primitivas
Si hemos de responder al interrogante anterior, tendremos que recurrir a los grupos de
ambas familias que son considerados más primitivos y advertir las semejanzas y diferencias. En
los Bruchidae tenemos a los Rhaebinae y los Pachymerinae como las subfamilias más primitivas,
mientras que en los Chrysomelidae contemplamos a los Sagrinae y Criocerinae como las más
antiguas. Aparte quedan los Megalopodinae y Orsodactinae, subfamilias aún más antiguas, que
según las modernas versiones (Reid, 1995) se desgajarían primitivamente como familias
individualizadas, presumiblemente después que lo hicieran los Cerambycidae.
Si comparamos las actuales subfamilias de Bruchidae y de Chrysomelidae, advertiremos
que hay dos subfamilias, los Rhaebinae (por parte de los Bruchidae) y los Sagrinae (por parte
de los Chrysomelidae) que mantienen las semejanzas más importantes entre ambas familias. Al
mismo tiempo, estas subfamilias ostentan, en cada familia, una posición primitiva, por lo que
cabría considerar que parte de la clave de las relaciones entre ambas familias haya que buscarla
en estas subfamilias.
a.-Rhaebinae. Estos insectos han tenido una historia de difícil ubicación. Presentan
caracteres intermedios entre los Bruchidae típicos y los Chrysomélidos, hecho por el cual unas
veces han estado fuera y otras dentro de la familia Bruchidae. Pero otros autores contemplaron
las estrechas relaciones entre Rhaebinae y Bruchidae, comenzando por Gebler (1830), aunque
fue Kraatz (1879) quien los incluyó entre los Bruchidae, una posición no aceptada por autores
como Shönherr (1833), Laporte (1840), Sturm (1843), Lacordaire (1845), Motschulsky (1845),
Suffrian (1867), Abeille (1868), Monros (1959) y Iablokoff-Khnzorian (1966, 1967), etc., que
pusieron a los Rhaebinae entre los Chrysomelidae, sea como subfamilia o incluidos dentro de
los Sagrinae. Más tarde Bridwell (1932) confirmaría su exclusión en su revisión supragenérica
de la familia, aún admitiendo la existencia de algunos caracteres comunes con los Bruchidae,
aunque restó importancia a estos caracteres por considerarlos demasiado generales en los
Chrysomeloidea; en cambio el citado autor encontró caracteres como la presencia de un segundo
diente cerca del ápice de la mandíbula y el hecho de no poder doblar la cabeza hacia abajo como
caracteres que le apartan de los Bruchidae.
Sin embargo, más adelante Crowson (1954) incluyó a los Rhaebinae dentro de los
Bruchidae. Recoge la polémica con los géneros Rhaebus Fischer, 1824, Eubaptus Lacordaire,
1845 y Bruchela Dejean,1821 (=Urodon Schöenherr,1826) y al respecto dice: “the first two of
these genera I think are certainly Bruchid though often referred to Chrysomelidae hitherto...” y
como argumento señala una característica biológica: todas las larvas de brúquidos (incluidas la
de Rhaebus) se alimentan de semillas de plantas con flores. En las claves que aporta, utiliza
caracteres como la ausencia de un meta-endosternito de tipo hilecoetoide, que está presente en
ciertos Chrysomelidae como los Sagrinae. Del mismo modo, Luckjanovitch y Ter-Minassian (1957), incluyen a los Rhaebinae en su fauna de Bruchidae de la URSS, dándoles el status de
subfamilia, con la que se ha mantenido hasta hoy día.
Pero el respaldo más rotundo par la inclusión de los Rhaebinae dentro de los Bruchidae
provino de Kingsolver y Pfaffenberger (1980), quienes partieron de un análisis morfológico y
biológico tanto del adulto como de la larva madura (la larva I es desconocida). Dichos autores
propusieron que el modo de vida espermatófagico, la forma de la genitalia del macho, las
antenas subaserradas, la presencia de quilla frontal en la cabeza, costilla lateral en el pronoto,
estrías elitrales y la estructura de las piezas bucales de la larva, eran suficientes para asignar a
los Rhaebus dentro de Bruchidae y excluirlos de los Sagrinae (Chrysomelidae) donde algunos
autores, como Iablokoff-Khnzorian (1966), los habían situado.
Sin embargo, Kingsolver y Pfaffenberger admitían que los Rhaebus se apartaban del
tronco principal de los Bruchidae típicos en caracteres tales como: fisura de las uñas tarsales,
metafémures ensanchados (sólo en machos), ojos profundamente emarginados, venación alar,
metatrocánteres elongados, metacoxas modificadas, terguitos 4º y 6º esclerotizados, puntas
cruzadas de las mandíbulas, cuerpo de color metálico, y comportamiento ovoposicional
aleatorio. Por otra parte, afirman que Rhaebus debe ser considerado un grupo ancestral de los
Bruchidae, al presentar caracteres arcaicos tales como: falta de valva ventral en la genitalia del
macho (aunque con lóbulos laterales formando una especie de cordón), antenas subaserradas,
escleritos mesopleurales no modificados, trocánteres presente en patas anteriores y medias,
presencia de costilla frontal, así como un surco parasutural, y la ausencia de palpos labiales en
la larva. Sin embargo, los autores admiten que una de las mejores evidencias para asegurar esta
vinculación con los Bruchidae, tal cual es la presencia de placa protorácica en forma de H o X
en la larva I, no ha podido ser determinada porque todavía se desconoce este estadio.
Más tarde Borowiec (1987) confirmaba estos caracteres pero señalaba la existencia en
los Rhaebinae de caracteres sagroides (plesiomórficos) y bruchoides (apomórficos). Así, según
este autor, los Rhaebinae poseen los siguientes caracteres sagroides: coloración metálica del
cuerpo; antenas subfiliformes, dos espolones apicales en las tibias posteriores, ancha placa
mesoepimeral ancha, alcanzando a las coxas medias, celda cerrada entre la primera y segunda
vena anal del ala, lóbulos medianos y laterales de tipo crisomeloide. Los caracteres bruchoides
de los Rhaebinae aparecen principalmente en las adaptaciones de la larva para desarrollarse
dentro de semillas de la planta huésped, en el desarrollo de quilla frontal y quilla pronotal
lateral, y en el aparato bucal de la larva de 2º estadio, especialmente en la reducción de los
palpos labiales. Desafortunadamente, el primer estadio larval de Rhaebinae todavía es
desconocido. La presencia de placa protorácica es el mejor carácter para separar la larva de los
Bruchidae de los Chrysomelidae.
b.-Sagrinae. Por parte de los Chrysomelidae tenemos que destacar la proximidad de los
Sagrinae, una subfamilia que conserva los caracteres que se consideran más primitivos de los
Chrysomelidae. Crowson (1954) distinguía entre los Sagrinae y los Bruchidae en sus claves de
Chrysomeloidea por caracteres tales como la existencia, en los Bruchidae, de márgenes laterales
en el protórax, estrías elitrales manifiestas, uñas tarsales más o menos apendiculadas o hendidas,
que no presentan los Sagrinae, y en cambio la presencia en éstos de alas con celda anal, metaendosternito
hilecoetoide, vertex con surcos, escudete con estriolas, además de que la larva tiene
palpos labiales bisegmentados, cardo maxilar bien desarrollado y patas bien desarrolladas, al contrario que los Bruchidae, por lo que no hay duda de que forman grupos muy diferentes. De
hecho, con anterioridad, el propio autor (Crowson, 1946) comparando el metaendosternito de
Rhaebus con el de algunos Sagrinae, y con otros Bruchidae, concluyó que esta estructura es
“esencialmente brúquida”.
Sin embargo, es cierto que algunas características son muy próximas a los brúquidos
más primitivos, como los Rhaebinae e incluso los Pachymerinae, como es la presencia de
fémures posteriores muy inflados y a menudo provistos de dientes, y tibias fuertemente
arqueadas y terminadas en espolón o mucro. Con los Rhaebinae coincide en caracteres
crisomeloides tales como la forma del pronoto y la coloración viva, brillante y metálica de sus
tegumentos. Kingsolver (1970) encontró semejanzas entre las formas más primitivas de los
Bruchidae y los Sagrinae en la forma de la genitalia del macho: lóbulo mediano curvado,
estructura tubular con base cucuyoide, ápice agudo y no modificado, saco interno armado con
escleritos diversos; lóbulos laterales fusionados basalmente y con porción ventral del anillo del
tegmen conectado con el borde basal del orificio del lóbulo mediano por una membrana
esclerotizada, formando en conjunto una estructura unitaria durante el apareamiento. La
genitalia del macho de los Rhaebinae es similar, apartándose de este tipo solamente en que el
cucullo y la porción apical del lóbulo mediano están articuladas al orificio basal de forma que
permite una flexión, aunque limitada, del lóbulo mediano, a diferencia del tipo brúquidosagroide,
que es más rígido.
Ante estas semejanzas, y obviando las diferencias señaladas entre Bruchidae y Sagrinae,
Crowson inició esta polémica manifestando varias veces la necesidad de igualar el status de
ambos grupos. Así, en 1954 decía: “if the present group is to be given family status, strict
phylogenetic logic would probably demand the dismemberment of both Cerambycidae and
Chrysomelidae...” (sic), de modo que llegó a sugerir que de no ser por las estrechas afinidades
de los Sagrinae con los Donacinae y Criocerinae, estaría tentado en proponer la inclusión de los
Sagrinae dentro de los Bruchidae. Sin embargo, en esta obra no termina de decidirse y en otra
siguiente (Crowson, 1960) vuelve a plantear el problema con otros términos al decir que los
caracteres larvales, y en alguna medida los de los adultos, establecen claramente la afinidad de
los Bruchidae y los Sagrinae, de modo que llega a ser difícil establecer la usual separación entre
ellos. Así pues, aunque Monros (1955) se pronunció claramente a favor de incluir los brúquidos
como subfamilia de los Chrysomelidae, Crowson no se definió abiertamente hasta más adelante,
llegando a proponer (Crowson,1981) que en los Bruchidae entraran no sólo los Bruchinae, sino
también los Sagrinae, Donaciinae y Criocerinae, pero, como dice Verma (1996), entonces
también deberían incluirse los Cassidinae y los Hispinae. Sólo más tarde, Mann y Crowson
(1981) llegarían a decidirse por la inclusión de los brúquidos como subfamilia en los
Chrysomelidae, siendo corroborado posteriormente por Reid (1995) entre otros.
Ciertamente, la afinidad de los Sagrinae con los Bruchidae es indiscutible, pero de
manera casi exclusiva con los Rhaebinae y ciertos Pachymerinae. Pero a partir de esta
constación, autores como Borowiec (1987) destacan una tendencia evolutiva de los Bruchidae
que les aparta de los Chrysomelidae, acumulando cada vez más apomorfías. En efecto, según
este autor, en la evolución de los Bruchidae, a diferencia de los Chrysomelidae, podemos asumir
las siguiente tendencias:
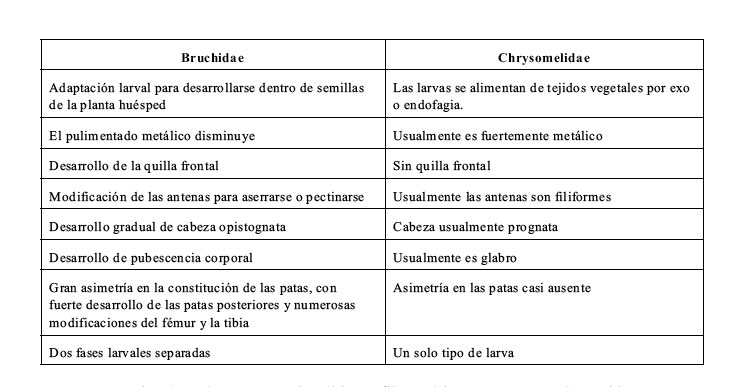 |
Cuadro 2. Comparación entre Bruchidae y Chrysomelidae
|
Borowiec (1987) reconoce el problema filogenético que se crea al considerar grupos
hermanos o parafiléticos a los Bruchidae y los Sagrinae, según lo cual en un sistema cladístico
los parafiléticos Bruchidae no pueden ser considerados como una familia separada sino que debe
tratarse como una subfamilia de los Chrysomelidae. Sin embargo el citado autor admite esto y
considera que los Bruchidae tienen tantos caracteres apomórficos que “desde el punto de vista
de la taxonomía evolutiva deben ser tratados como una familia separada” (Fig.8).
Verma (1999) encuentra nuevos argumentos para apoyar las relaciones filogenéticas
entre Bruchidae y Chrysomelidae. Se trata de la existencia de polimorfismo morfológico y
fisiológico en ambos grupos. En efecto, es conocida la existencia de formas sedentarias y formas
voladoras (llamadas “activas”) en algunos brúquidos, como ciertos Callosobruchus Pic,1902,
que al parecer también se conoce en algunos crisomélidos como Chrysolina aurichalcea. Verma
concluye que si el polimorfismo en ambos grupos es comparable, se podría inferir que hay
potenciales genéticos comunes en los dos grupos de fitófagos. Pero ante estas evidencias la
autora considera que el fenómeno de polimorfismo en ambos grupos ha debido de ser resultado
de una estrecha polifilia o paralelofilia, es decir, ambos grupos han evolucionado por separado
conservando caracteres de varios antepasados comunes a ambas líneas evolutivas.
Las evidencias del registro fósil
En esta discusión nos parece relevante introducir un nuevo elemento de juicio, a menudo
despreciado por los investigadores filogenéticos, consistente en el registro fósil. Ciertamente éste
no es muy completo y frecuentemente es difícil de estudiar, pero en ocasiones pueden ser bien
caracterizados y utilizar un valioso recurso del que no disponíamos hasta el momento: la
datación. Al respecto, sabemos que de los Sagrinae se disponen de escasos fósiles, siendo los
más importantes los descritos por Haupt (1950) de los carbones marrones del Eoceno de
Alemania (Eosagra Haupt, 1956), lo que a falta de más datos podría representar un punto de
referencia para calibrar los árboles filogenéticos hipotéticos que relacionen Bruchidae con
Sagrinae.
Seguramente el desarrollo de los Bruchidae
empieza durante el periodo de evolución de las
angiospermas, probablemente a finales del periodo
Cretáceo. Como hemos señalado anteriormente, uno de los
argumentos utilizados por Lawrence y Newton (1982) para
situar a los Bruchidae como subfamilia de los
Chrysomelidae es la falta de fósiles del Mesozoico. Esto ha
sido cierto durante un tiempo, pues ciertamente además del
Caryobruchus dominicanus del ámbar dominicano (Poinar,
1999), datado del Eoceno Inferior, sólo conocemos el
Oligobruchus creado por Kingsolver (1965) para la especie
tipo Bruchus florissantensis Wickh., procedente de la
formación de Florissant, que está datado de finales del
Eoceno al Oligoceno. No obstante, hay que señalar que por sus características se trata de un
Pachymerinae, ciertamente uno de los grupos más primitivos, pero ya diferenciado de los
Sagrinae. Borowiec (1987) dice al respecto que, aparte de las numerosas características
pleisomórficas, el género muestra algunas apomorfías (disco pronotal convexo, proceso
prosternal estrecho, tibias medianas con costilla y ojos profundamente emarginados). En ninguno
de los Pachymerinae extinguidos está el disco protorácico tan densa y profundamente foveolado
como en Oligobruchus.
|
|
 |
Puede presumirse por tanto que los escarabajos de las semillas ya eran
un grupo bien diferenciado en el Oligoceno, y la subfamilia Pachymerinae es, después de la
Rhaebinae, una de las más derivadas. Posteriormente, Zherichin (1989) describió el
Oligobruchus kingsolveri (Fig.6), igualmente de una formación del Eoceno-Oligoceno, pero de
un lugar |
|
Figura 6.- Dibujo de Oligobruchus kingsolveri Zerichin (1989)
|
mucho más alejado (Siberia), mostrando que el mismo género ya debió de estar
ampliamente repartido por toda la región Holártica a principios del Cenozoico.
 |
|
Pero es relevante señalar, para el objeto de este artículo, que en la misma formación de
Florissant, también fueron halladas especies del género Bruchus (B.abororignalis
Wickham,1914., B. antaeus Wick,1917.; B.
dormescens Wick.,1913, etc.) y Spermophagus (S.
pluto Wick,1914.), así como en la formación de White
River, del género Bruchus (B. anilis Scudder,1876) y
Spermophagus (S.vivificatus Scud.,1876), que
representan taxones más derivados que los
Oligobruchus, por lo que cabe suponer que los
antecesores de los Bruchidae debieron de ser pre-
Terciarios, pues a principios del Cenozoico muestran
evidencias de una consolidación como familia y una
amplia dispersión antes de la separación de los
continentes por los procesos tectónicos.
|
Figura 7. Dibujo de Mesopachymerus antiqua
Poinar (2005) (original de Poinar). |
|
|
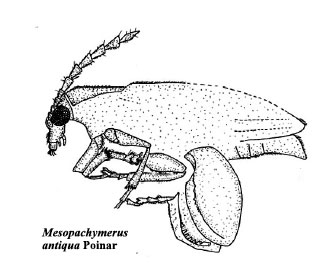
Apoya esta tesis el hallazgo reciente de otro brúquido, Mesopachymerus antiqua (Poinar,
2005, Fig.7) en ámbar canadiense, de la Formación Foremost (Judith River) datado del
Campaniense Cretácico (79 m.a. según datación radiométrica), abre nuevas expectativas para
esta discusión. Se trata de un coleóptero con caracteres sagroides, pero sin colores metalizados,
lo que junto a los metafémures inflados y con un pecten en su borde inferior, lo sitúa entre los
Pachymerinae, y dentro de éstos, la presencia del 1º segmento metatarsal ensanchado, rostro corto, sin seno ocular, la estructura de pecten y prepecten y carena pronotal completa, le llevó
a consideralo de la tribu Pachymerini. Se trata de la primera descripción de un fósil de brúquido
en el Mesozoico
Poinar (2005) propone una nueva hipótesis sobre el origen y dispersión de los brúquidos
a la vista de estos nuevos datos. Frente a la hipótesis imperante de un origen de los Bruchidae
durante el Terciario (Lawrence and Newton, 1982) y que se originaron en el primitivo
Gondwana (Nilsson, 1992), esta nueva evidencia fósil indica que los brúquidos más primitivos,
esto es los Pachymerinae, se originaron en la zona Neártica a finales del Jurásico y principios
del Cretácico cuando las condiciones eran tropicales a subtropicales. Durante esta época estos
insectos se dispersaron por la región Paleártica a través del puente de tierra de Beringia, que
estuvo presente a finales del Cretácico y continuó intermitentemente abierto durante el Eoceno
al Oligoceno. Estos insectos alcanzarían entonces Africa durante el Mioceno, cuando la placa
africana estaba en contacto con el sur de Europa y también migrarían a Sudamérica a través de
los puentes terrestres Thuleanos, cuando la placa del Caribe puso en contacto a ambos
continentes en la zona de Centroamérica hace 65 m.a. Apoya este origen nortemamericano de
los Bruchidae el hecho de que allí también se encontrara en el Eoceno otros Pachymerinae como
el Oligobruchus de Kingsolver. Dado que estos brúquidos son de la tribu Caryopemini, que hoy
día están exclusivamente en el Viejo Mundo, la presencia de tanto Pachymerini
(Mesophachymerus Poinar) como Caryopemini (Caryobruchus Bridw., Oligobruchus Kings.)
en el Cretácico de la zona Neártica indica que se dieron varios tipos de Bruchidae durante el
Eoceno en el Nuevo Mundo. La migración de los Caryopemini al Viejo Mundo probablemente
se produjo a finales del Eoceno, ya que las masas de tierra del norte durante el Eoceno
posiblemente fueran hostiles durante el Oligoceno, cuando el clima se enfrió significativamente.
En cuanto a los huéspedes posibles, Poinar (2005) señala, para su Mesopachymerus que,
dada la casi absoluta preferencia de los Pachymerinae por las Palmáceas, cabe pensar que las
semillas de Palmáceas fueron los huéspedes originales de los brúquidos en Norteamérica, ya que
no hay fósiles de Leguminosas en el Cretácico y en cambio sí hay varios fósiles de géneros de
Palmáceas que actualmente son huéspedes de Pachymerinae. En cambio, Kingsolver (1965)
considera que la presencia de fósiles de Leguminosas y ninguno de Palmáceas en la formación
de Florissant (Oligoceno), donde se encontró el Oligobruchus Kings., cabe pensar que el huésped
de este Caryopemini era una legumbre, como otros géneros de esta misma tribu (Caryedon
Schönherr, 1827, Caryopemon Jekel,1855), bajo un clima subhúmedo y cálido, muy parecido
al actual clima preferente de este grupo.
Llegados a este punto crucial, nos encontramos con al menos una especie fósil
perteneciente a la subfamilia Pachymerinae, un grupo ya diferenciado o consolidado de los
Bruchidae en un momento anterior a la aparición de los primeros fósiles de Sagrinae ,ya que los
más antiguos que se conocen están datados del Eoceno (Eosagra Haupt), como hemos visto.
Esto plantea un problema para los que afirman un origen hermano de Bruchidae y Sagrinae,
aunque reconocemos que esto no puede ser todavía un argumento concluyente pues el registro
fósil es muy escaso y no podemos saber si hay fósiles de Sagrinae más antiguos y coetáneos con
los Bruchidae. Como tampoco hay evidencia fósil de un hipotético ancestro común de
Rhaebinae-Pachymerinae y Sagrinae. Ciertamente se conocen fósiles atribuidos a los
Chrysomelidae (Santiago-Blay, 1994), aunque como afirma Reid, son poco reconocibles, pero
en cualquier caso, se sabe que al menos un Donaciinae en ámbar es pre-Terciario (Askevold, 1990). En cualquier caso es evidente que ambos grupos coexistían y ya estaban diferenciados
en líneas separadas a finales del Mesozoico, prácticamente coincidiendo con el inicio de la
radiación de las Angiospermas, sus plantas huéspedes, lo que pone cada vez más en tela de juico
la hipótesis de que los brúquidos son derivados de los Sagrinae, pues realmente queda muy poco
tiempo para que se produzca la derivación de un grupo del otro.
Esquemas evolutivos
Crowson (1960) consideraba que los Bruchidae tenían caracteres más derivativos
(apomórficos) que los Sagrinae, por lo que consideraba fácil imaginar que sus hábitos larvales
fueran adquiridos a partir de los de los Sagrinae. Por debajo de éstos se situarían los
Cerambycidae como pos Polyphaga más primitivos, y entre éstos y los Sagrinae se hallarían los
Megalopodinae u Orsodacninae, que estarían en
la base del tronco de los Chrysomelidae. El árbol
filogenético que representa Crowson para esta
familia tendría pues una rama de Bruchidae que
derivaría de los Sagrinae, lo que significaría
mantener a los Bruchidae dentro de los
Chrysomelidae con el rango de subfamilia, al
igual que los Sagrinae, pero con la diferencia de
que mientras que los Bruchidae tuvieron una
radiación evolutiva, los Sagrinae evolucionaron
relativamente menos. Estas ideas las desarrolla
mejor en un trabajo posterior sobre las formas
más primitivas de los Chrysomelidae (Man y
Crowson, 1981).
Esta propuesta ha sido aceptada por otros
autores posteriores. Así, Lawrence y Newton
(1982) en su revisión sobre clasificación y
evolución de los Coleópteros, admiten el
planteamiento de Crowson al afirmar que hay
una evidente e indiscutible asociación de los
Bruchidae con el complejo Sagrinae-Criocerinae, añadiendo que tanto por la distribución
geográfica, como por la asociación con plantas húespedes y la falta de fósiles Mesozoicos,
sugiere que los Bruchidae forman un grupo muy joven, por lo que en el terreno filogenético, la
única alternativa es tratar al grupo como una subfamilia cerca de los Sagrinae, o bien dar al
conjunto de los Sagrinae-Criocerinae el rango de
|
|
|
familia. Como hemos visto, esto ha cambiado
sustancialmente, pues ahora sabemos que antes del Cenozoico ya había una diversificación de
los brúquidos. Tal vez por ello, el árbol filogenético que propone Borowiec (1981)
sitúa a los
Sagrinae como antecesor común de Chrysomelidae y Bruchidae, son
|
|
Figura 8.- Esquema evolutivo de los Chrysomeloidea según Borowiec (1981) (retocado del
original).
|
una separación previa del
tronco por parte de los Cerambycidae (Fig.8), una posición difícil pues sitúa a los Sagrinae como
grupo “padre” en lugar de “hermano” de los Bruchidae, como se venía aceptando.
Sin embargo, por razonable que pueda parecer esta propuesta, encontramos ciertas
dificultades. Así, si se admite que tanto los Bruchidae como los Chrysomelidae derivan de los
Sagrinae, es un tanto artificioso que éstos aparezcan actualmente como subfamilia con un status igual que el resto de los Chrysomelidae (además de los Bruchidae), cuando partimos de la
consideración de que éstos derivan de los Sagrinae. Esto podría contestarse señalando que los
Sagrinae actuales son formas derivadas, aunque con muchos menos cambios o apomorfías, de los
primitivos Sagrinae, en cuyo caso los primitivos deberían ser denominados “Paleo-Sagrinae”.
Pero si esto es así, no hay motivo alguno para empeñarse en mantener un status de subfamilia a
un grupo tan evolucionado como los Bruchidae, que llegó a acumular tal cantidad de caracteres
apomórficos que sólo la presencia de unos pocos caracteres sagroides o pleisomórficos, más
abundantes en las subfamilias primitivas de los Bruchidae (Rhaebinae, Pachymerinae) podría
hacer reconocer su parentesco con los Sagrinae, con los que comparte genes de antepasados
sagroides (Paleo-Sagrinae) antes de que se bifurcaran definitivamente en familias distintas.
Todos estos grupos primitivos de Bruchidae y Chrysomelidae, tienen en común un
carácter muy llamativo: fémures posteriores muy ensanchados y a menudo armados
(denticulados) en su borde inferior. De hecho, los brúquidos fósiles hasta ahora conocidos ya
presentan este carácter. Crowson (1954) advirtió esta coincidencia y señalaba que “parece que
hay cierta correlación entre el tipo fuertemente inflado de fémures posteriores que se da en
Brúquidos y ciertos Chrysomélidos, y el hábito de mantenerse con cabeza hacia arriba en los
tallos delgados, en cuya posición parece que el peso entero del insecto parezca estar soportado
por las patas posteriores, posición que junto con el desarrollo de los ojos hacia la parte ventral
del cuerpo le permitiría advertir la aproximación de enemigos potenciales por debajo”. Sin
embargo, Kingsolver y Pfaffenberger (1980) consideran que, si bien la presencia de fémures
inflados (al menos en los machos) frecuentemente con armadura ventral es común en Bruchidae
(incluidos los Rhaebinae) y Sagrinae, no está claro que la dilatación del metafémur deba ser
considerado un carácter ancestral para ambos grupos, dado que en estos dos grupos también se
dan formas con fémures ligeramente inflados o normales, considerando que posiblemente éste
sea un carácter derivado ligado al arqueamiento de la metatibia. Su función no está clara y el
carácter es compartido por otros grupos de coleópteros, como son los Oedemeridae, donde
igualmente es más destacado en los machos. En otros casos, como los Alticinae, este desarrollo
tiene que ver con su habilidad para lograr dar saltos de gran envergadura, pero éste no es el caso
de los Bruchidae y Sagrinae.
Estudios cladogenéticos
En los últimos años se ha ido desarrollando una nueva línea de investigación que está
cosechando importantes frutos en el terreno de la taxonomía, la filogenia y la evolución. Se trata
de la taxonomía filogenética, iniciada por Queiroz y Gauthier (1992), que en el caso de los
Chrysomeoidea han sido desarrollada principalmente por Reid (1995) (2000). Como vimos
anteriormente, este influyente trabajo ha respaldado la tesis de la inclusión de los Bruchidae
dentro de los Chrysomelidae como subfamilia (Bruchinae) en íntimo parentesco con los Sagrinae,
posición que ha sido seguida por otros autores posteriores (ej.Farrell y Sequeira, 2001). Sin
embargo, a nuestro entender, este estudio sólo demuestra que efectivamente hay cierto parentesco
(pensamos que residual o lejano) entre ambos grupos, no necesariamente que ello suponga su
inclusión en la misma familia. En realidad la magnitud de esta cercanía es difícil de establecer
de manera absoluta, pues depende mucho de los caracteres elegidos para establecer las
asociaciones filogenéticas en el análisis cladístico. De hecho, observamos que, de los 71
caracteres que Reid utiliza hay 9 caracteres del adulto y 7 de la larva en que coinciden Brúquidos
y Sagrinos, pero en realidad tan sólo el carácter nº 49 (cabeza elongada en la larva) se puede decir que es exclusivo de ambos grupos, y en todo caso pudiera estar relacionado con la vida endofita
de sus respectivas larvas, lo que podría ser una mera convergencia evolutiva. De hecho, el propio
Reid (1995) señala que su cladograma alcanza un índice de consistencia de tan sólo 0,4 y no
indica el índice de retención. Pensamos que el resultado habría sido muy diferente de usar,
además, los caracteres que los brúquidos no comparten con los restantes Chrysomeloidea
(nosotros hemos contabilizado más de 40 caracteres exclusivos de brúquidos). Presumiblemente,
los resultados habrían sido muy diferentes, seguramente distanciando el supuesto parentesco con
los Sagrinae. En todo caso, nos parece que la base para el cambio de status de familia a
subfamilia todavía es débil. No es cuestión de sobrevalorar los argumentos taxonómicos sobre
los filogenéticos. Estamos de acuerdo con Reid en que la taxonomía, como ciencia, se basa en
hipótesis, pero al mismo tiempo, el propio autor (Reid, 1995 p.603) reconoce que, por su parte,
la filogenia sólo es tentativa en niveles supra-genéricos.
Estos interesantes estudios se complementan con un enfoque novedoso iniciado por
Becerra (1997) inspirado en la seminal obra de Ehrlich y Raven sobre la coevolución. Para la
autora, la determinación de la importancia macroevolutiva de la química vegetal en los cambios
de huésped en los herbívoros es crítica para comprender la evolución de las interacciones plantainsecto.
Usando métodos de filogenia molecular en antiguas especies de Chrysomelidae, adviritó
que los patrones históricos de cambios de huésped corresponden fuertemente con los patrones de
similaridad química, indicando que la química vegetal ha jugado un papel significativo en la
evolución de los cambios de huéspedes por los insectos fitófagos.
Farrell y Sequeira (2001) prosiguieron con estos estudios para determinar las tasas de
radiación adaptativa de los coleópteros sobre las plantas, en especial los Chrysomeloidea, cuya
diversidad se ha atribuido a su asociación con las angiospermas. Los autores encontraron una
diferencia significativa en las tasas de cambio evolutivo en dos dimensiones de uso del huésped:
la especialización de un taxón-huésped y el uso de tejidos especiales, siendo la más exitosa las
asociaciones con varias taxa-huéspedes. La hipótesis que manejan los autores es que esta
diversificación se produjo a partir de insectos ligados a gimnospermas en el Jurásico, que
encontraron a partir del Cretácico, con la diversificación de las angiospermas, una rápida
radiación evolutiva que incluyó la especialización en nichos ecológicos diferenciados de las
plantas (hojas, semillas y raíces), momento en que se separarían los Curculionoidea de los
Chrysomeloidea. En los Chrysomeloidea de vida exofita la competencia estimularía una fuerte
diversificación, con excepción de grupos que regresan a la vida endofita, como los brúquidos.
Pero los autores señalan que si bien los Chrysomeloidea de vida exofita usan un abanico mucho
más amplio de húespedes que los brúquidos, no está claro, a nivel de especie, si los exofitos
cambiaron de huésped más rápidamente que los endofitos (brúquidos). Partiendo de la hipótesis,
ya defendida por Reid (1995) de que brúquidos y sagrinos son grupos hermanos (de hecho en sus
cladogramas aparecen ambos como subfamilias dentro de los Chrysomelidae), señala que la
relación de hermandad entre los espermófagos (Bruchinae) y comedores de tallo e inductores de
agallas (Sagrinae) sugiere una progresión desde comedores de tallos e inductores de agallas
ancestrales (que podríamos llamar paleo-Sagrinae) de finales del Cretácico, de modo que los
Bruchinae aparecerían como el grupo de espermófagos más joven de los insectos herbívoros,
encontrando en este nuevo nicho ecológico prácticamente ninguna competencia interespecífica.
Sin embargo, no encontramos justificación para mantener que este ancestro, supuestamente
común, tenga que ser de tipo Sagrinae (comedor de tallos e inductor de agallas), pues aunque
comparta con los Bruchinae la vida endofita y algunos rasgos morfológicos ancestrales, son nichos ecológicos muy diferentes y con exigencias adaptativas muy distintas y tampoco hay
motivo para considerar que los Sagrinae sean más antiguos que los Bruchinae, cuando, al menos
por el registro fósil, resulta ser todo lo contrario. Nada nos dice que los brúquidos aparecieron
cuando los crisomélidos estaban consolidados como familia, siendo verosímil considerar que más
bien se tratara de una de las ramas de los paleo-crisomeloideos que radiaron con la aparición de
la Angiospermas, cada rama en nichos ecológicos diferenciados.
Con esta orientación, Romero y Johnson (2002), dos conocidos especialistas en
Bruchidae, también han abordaron estudios de este tipo, partiendo de la estrecha relación que
existe entre brúquidos y sus huéspedes y que ello puede fundamentar mecanismos de coevolución
o al menos de interacción entre brúquidos y plantas huéspedes, ya que con frecuencia los
huéspedes de estos insectos presentan diversos mecanismos de defensa, especialmente la
producción de sustancias aleloquímicas, a menudo tóxicas o inhibidoras de la fisiología
nutricional del insecto. Si esto es así, la actual oligofagia que exhiben estos insectos podría estar
justificada como el resultado de una evolución en la que el insecto ha logrado superar estas
defensas. Lo pertinente de esta premisa es que los citados autores consideran que los estudios
cladogenéticos en los Bruchidae deben realizarse oponiendo los cladogramas de los insectos con
la de sus plantas hospedadoras. De este modo, idealmente los esquemas cladísticos son necesarios
para derivar explicaciones válidas de las relaciones evolutivas entre plantas e insectos, como la
hipótesis de que las subfamilias actuales de los Bruchidae se originaron de un antecesor del tipo
Pachymerinae.
Siguiendo esta línea de investigación, posteriormente Kergoat et al.(2005) realizaron un
interesante estudio sobre la evolución paralela de los dos géneros más grandes de brúquidos del
Nuevo Mundo (Acanthoscelides Schilsky,1905) y del Viejo Mundo (Bruchidius Schilsky,1905),
partiendo de la consideración de que ambos géneros acusaron una importante radiación
adaptativa de estos fitófagos en angiospermas huéspedes, gracias a la enorme disponibilidad de
nichos ecológicos (semillas) en el momento en que iniciaron su especiación. Estos autores
emplearon modernos métodos de filogenética molecular, empleando genes de ADN mitocondrial.
Los autores no se manifiestan a favor o en contra del mantenimiento del status de familia en los
Bruchidae, pero lo aceptan en esta publicación por razones de “conveniencia”. Entre los
interesantes hallazgos de su trabajo (entre los cuales se encuentra un perfecto ajuste de evolución
de insectos y plantas huéspedes en una línea coevolutiva y la parafilia de ambos géneros)
destacamos, para el objeto de este artículo, su estimación de los tiempos de divergencia mediante
el reloj molecular, indicando que el origen más antiguo es de 70 m.a., una edad que les pareció
más alta que la registrada por los fósiles conocidos entonces (50 m.a.), si bien el descubrimiento
de Mesopachymerus Poin. del Cretácico, con una datación de 79 m.a., encaja perfectamente (de
hecho se anticipa) con este tiempo estimado por el reloj molecular. Lo interesante del hallazgo
es que esta estimación aparece referida al momento en que se produce la separación de las dos
ramas de brúquidos que dieron lugar a los actuales Acanthoscelides Schils. para el Nuevo Mundo
y Bruchidius Schils. para el Viejo Mundo, coincidiendo con la separación de las placas tectónicas
por la expansión del océano Atlántico y la desaparición del puente terrestre Tuleano. Los autores
infieren que en este momento ambos grupos experimentan una fuerte radiación adaptativa al
colonizar nichos ecológicos nuevos: las semillas de Leguminosas, que también iniciarían su
evolución en este momento, reforzando ello las hipótesis coevolucionistas (Herendeen et
al.,1992). Esta hipótesis de radiación adaptativa se apoya al menos en dos de las cuatro
características señaladas por Shluter (2000) para este tipo de eventos: la existencia de ancestro común y la utilidad de los caracteres en evolución (representados por innovaciones clave que
están implicadas en los mecanismos de detoxificación de las semillas). En cambio, los autores
no pudieron encontrar una fuerte correlación fenotipo-medio por la ausencia de fuertes
diferenciaciones morfológicas en los Bruchidae, así como tampoco encontraron evidencias de una
rápida especiación pues sus estimaciones evidenciaban un ritmo más lento y tiempos de
divergencia más espaciados, por lo que los autores apuntan sobre la necesidad de investigar sobre
posibles eventos vicariantes más recientes. La estimación de Kergoat et al.(2005) de la hipótesis
alternativa excluye la hipótesis de un evento vicariante más antiguo, encontrado en otros
Chrysomeloidea (Becerra, 2003), basado en la ruptura del oeste del primitivo Gondwana (entre
Africa y Sudamérica) hace 100 m.a.
Estos hallazagos tienen relevancia para el problema que estamos analizando pues si la
diversificación de dos grupos tan evolucionados respecto de los Pachymerinae, como son los dos
géneros de Bruchinae examinados, se produjo hace 70 m.a. (recordemos que el fósil más antiguo,
Mesopachymerus Poin., tiene 79 m.a.), significa que la separación de los Bruchidae de los “paleo-
Chrysomelidae” se debió de producir mucho antes de lo estimado hasta ahora, aunque después
de que lo hicieran los Cerambycidae, probablemente entre este evento y la aparición de las
primeras Angiospermas. Recordemos que de los Sagrinae, sólo tenemos una referencia fósil muy
posterior (50 m.a.) y que su distribución está menos extendida: Borowiec (1987) afirma que los
primitivos Sagrinae se originarían de las partes meridionales del viejo continente desde el que
migraron y se dispersaron para ocupar el conjunto del Viejo Mundo y Sudamérica. En cualquier
caso, todo parece indicar que la separación del nicho ecológico endofito (espermatofágico) de
los Bruchidae respecto del resto de lo “paleo-Chrysomelidae” se produjo mucho antes de
consolidarse los Chrysomelidae (posiblemente a finales del Jurásico), si bien es cierto que
algunas de sus actuales subfamilias conservan todavía parte del patrimonio genético del tronco
común que compartían con los Bruchidae, ambos grupos evolucionaron en nichos separados
acusando, a partir de la aparición de las primeras angiospermas, una fuerte radiación evolutiva
y acumulando una gran cantidad de rasgos morfológicos y fisiológicos netamente diferenciados,
con mucho mayor éxito evolutivo para los Bruchidae que para los Sagrinae.
Discusión
Jolivet (2004), un prestigioso y conocido especialista en los Chrysomelidae, no duda en
indicar la necesidad de mantener a los Bruchidae como familia aparte de los primeros. En su
reseña sobre el libro de Arnett et al.(2002) sobre los coleópteros americanos, este venerable autor
decía:
“thanks to God and John Kingsolver, the Bruchidae were considered an independent family, and were not
amalgamated within Chrysomelidae”
y a continuación también dejaba entrever la falta de consenso en la comunidad científica sobre
la propuesta actual de dividir los Chrysomelidae en tres familias (Megalopodididae,
Orsodactinidae y Chrysomelidae). Lo que es evidente, a partir de estas controversias, es que
todavía no hemos acumulado los suficientes argumentos como para lograr la aceptación general
de estas propuestas de renovación de los Chrysomeloidea.
No es nuestra pretensión en este artículo avivar una polémica científica (más allá de replantearla), ni alimentar un enfrentamiento estéril entre taxónonomos y filogenéticos, ni
alinearnos con las corrientes, creemos que minoritarias, de “clado-escépticos”. La importancia
de la labor de la filogenia es indiscutible y cualquier taxónomo debe contemplar las aportaciones
de la filogenia como una lúcida contribución al conocimiento de las relaciones evolutivas entre
las especies de seres vivos, habiendo resuelto problemas que de otro modo hubieran sido
irresolubles y abriendo nuevos interrogantes y perspectivas, como el que nos ocupa, necesarios
para el avance de la ciencia. Es innecesario, por obvio, reclamar el obligado hermanamiento
fructífero entre taxonomía y filogenia para la construcción de una clasificación natural y
evolutiva de los seres vivos. De hecho, en la bruquidología actualmente se está concretando esta
fructífera interacción entre filogenéticos y taxónomos (ej.Kergoat et al.,2004; Romero-Nápoles,
2002; etc.), abriéndose un camino que, sin duda, cosechará importantes hallazgos.
|
Figura 9.- Esquema evolutivo propuesto para los Chrysomeloidea. |
Consideramos que posiblemente el error que ha llevado a esta polémica ha sido considerar
a los Sagrinae como “grupo hermano” de los Bruchidae, tanto por parte de defensores como de
detractores del status de familia, pues efectivamente en este caso habría que considerar a los
Bruchidae, coherentemente con la ortodoxia filogenética, con el mismo rango: o los Sagrinae se
elevan a familia (y con ello las restantes subfamilias de los Chrysomelidae) o los Bruchidae se
incluyen como subfamilia en los Chrysomelidae. Cabría incluso la posibilidad de incluir los
Sagrinae dentro de los Bruchidae, pero esto acabaría definitivamente con la singularidad de los
Bruchidae.
Nosotros no negamos el parentesco entre estos grupos, pero no tan próximos como
considerarlo como “hermanos”, pues pensamos que no se han tenido en cuenta otros factores
como los de tipo paleoecológico, paleontológico y paleobiogeográfico que podrían conciliarse
admitiendo la posible existencia de ancestros comunes no-Chrysomelidae, aunque ciertamente
con caracteres sagroides. Pensamos que lo más sensato, a la vista de los datos disponibles, es
admitir que, efectivamente, los Sagrinae tienen antepasados comunes con los Rhaebinae-
Pachymerinae, pero previamente a la individualización de los Chrysomelidae (Fig.9). Desde estos ancestros sagroides no-Chrysomelidae (que hemos llamado Ancestro Sagroide), se
individualizarían las dos familias en dos nichos ecológicos bien diferenciados de vida:
espermófaga (paleo-Bruchidae)y foliófaga (paleo-Chrysomelidae), paralelamente a la explosión
de las Angiospermas. Los actuales Sagrinae (de los Chrysomelidae) y Rhaebinae-Pachymerinae
(de los Bruchidae) conservan aquellos caracteres del eslabón primitivo que hemos llamado
sagroide, pero al evolucionar en nichos ecológicos diferenciados, han llegado a diversificarse
cada uno en las diversas subfamilias actualmente conocidas de cada familia. Si, tal como muestra
el registro fósil, los brúquidos primitivos (que darían lugar a los Rhaebinae y Pachymerinae) se
aislaron ecológicamente (posiblemente por una macromutación, si seguimos la corriente
macroevolucionista) respecto a los restantes Chrysomelidae, antes de que iniciaran su fortísima
radiación evolutiva como foliófagos que diera lugar a sus actuales subfamilias, es razonable
pensar que, aún reconociendo un tronco sagroide común, ambos grupos se bifurcaron ecológica
y morfológicamente desde muy temprano en la evolución de la superfamilia (y posiblemente
antes de que aparecieran los Sagrinae), dando lugar a dos familias bien diferenciadas: los
Bruchidae, por un lado y los Chrysomelidae, por el otro. En este esquema, los Sagrinae
representarían un grupo que hoy conserva, como también lo hacen los Rhaebinae-Pachymerinae,
rasgos residuales (sagroides) del patrimonio genético del primigenio tronco común, algo de lo
cual todavía se conserva puntualmente en otros grupos de Chrysomelidae, como los Criocerinae,
Donacinae, Hispinae, etc. Dicho de otra manera, el clado que resuelve la parafilia de brúquidos
y chrysomélidos no es la familia, sino la superfamilia, pues no está claro que el nodo de
bifurcación entre ambos grupos sea un chrysomélido en sentido estricto (Fig.6).
Conclusión
En este artículo reflejamos nuestras dudas de que los hallazgos desde la investigación
filogenética conduzcan necesariamente a la consideración de los brúquidos como subfamilia
dentro de los Chrysomelidae. Mantenemos que, por ahora, los argumentos para mantener a los
brúquidos como familia son más convincentes (si nos atenemos no sólo a los ya conocidos
argumentos morfológicos y ecológicos, sino también los más recientes datos paleontológicos y
paleogeográficos) y también más convenientes (si partimos de la base de que a fin de cuentas lo
importante, en este intervalo de confrontación científica, es mantener la estabilidad del sistema
en aras de una fluida e inequívoca comunicación), por lo que desde nuestra modesta posición, nos
sumamos a la comunidad de científicos que todavía sostienen la necesidad de mantener por ahora
el status de familia para los brúquidos, obviamente manteniéndonos abiertos a los posibles
cambios que pueda ir introduciendo la investigación científica en torno a este problema
taxonómico. En todo caso queremos dejar bien claro que nuestra posición no obedece solo a
“razones políticas” (Reid, 2000) o “de conveniencia” (Schmitt, 1989), sino también a razones
científicas que consideramos dignas de consideración.
